基礎研究室のご紹介
この記事の内容
消化管外科の基礎研究紹介
消化管外科では「基礎研究」と「臨床研究」を研究の両輪と位置づけ、これらを統合する「translational research」を行うための科学的思考力を有する外科医、surgeon scientistの育成に励んでいます。
その一環として、大学院の消化管外科基礎研究室では、様々な研究テーマで研究を行っています。
また、大学院生の希望に応じて、消化管外科以外の研究室でも、学内・学外を問わず、以下のような研究室で研究指導を受けている大学院生もいます。
- 病態生物医学(松田道行教授)
- 腫瘍生物学(小川誠司教授)
- 細胞機能制御学(岩井一宏教授)
- 大腸がん新個別化治療プロジェクト(武藤誠教授)
- 再生医科学研究所生体材料学(田畑泰彦教授)
- iPS細胞研究所増殖分化機構研究部門(金子新教授)
- クリニカルバイオリソース研究開発講座(井上正宏教授)
- 大阪大学微生物病研究所遺伝子生物学分野(原英二教授)
- 医薬基盤・健康・栄養研究所プロテオームリサーチプロジェクト(朝長毅先生)
- がん研究会がんプレシジョン医療研究センター(清谷一馬先生)
- 国立がん研究センター研究所エピゲノム解析分野(牛島俊和先生)
- 大阪国際がんセンター研究所がん創薬部(田原秀晃先生)
- がん研究会がん研究所細胞生物部(八尾良司先生)
癌の分子生物学的研究と臨床応用
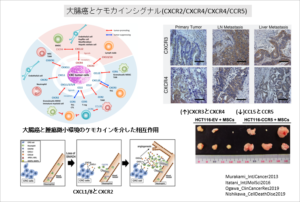
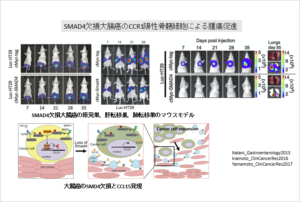
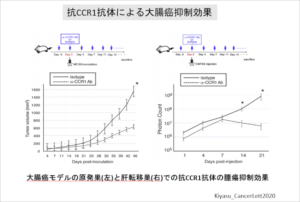
大腸癌の転移・浸潤機序の研究
大腸癌の腫瘍微小環境での、癌細胞と宿主細胞との相互作用から、大腸癌の浸潤・転移のメカニズムの解明を目指します。
大腸癌は様々なケモカインリガンド(CCL15、CCL5、CXCL1、CXCL8など)を分泌し、対応するケモカイン受容体を有する宿主細胞が腫瘍微小環境で癌細胞の進展を幇助すると考えられます。
これらの詳細な機序を解明することで、新規治療ターゲットを探索し、新たな治療方法開発を目指します。
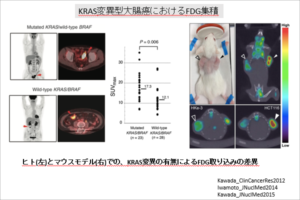
KRAS遺伝子と癌代謝
大腸癌治療においてKRAS遺伝子変異は抗EGFR抗体治療におけるバイオマーカーとして使用されています。
KRAS変異型の大腸癌は代謝型と呼ばれ、糖代謝が亢進した結果PET検査におけるFDG集積が亢進することを報告しており、現在KRAS変異特有の代謝異常に着目した新規治療薬の開発を目指しています。
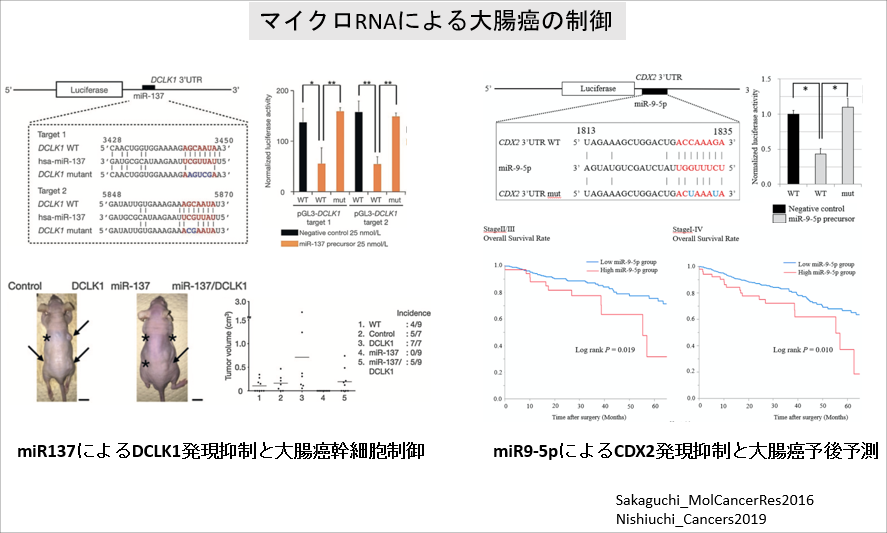
マイクロRNAによる大腸癌の制御
マイクロRNA(miR)は遺伝子の発現制御を行っています。
大腸癌においてmiR137はDCLK1の発現を抑制しており、大腸癌幹細胞ではmiR137の発現が低下しています。
また、miR9-5pはCDX2の発現を抑制しており、miR9-5pの発現が高い大腸癌患者では予後が悪いことを見出しました。
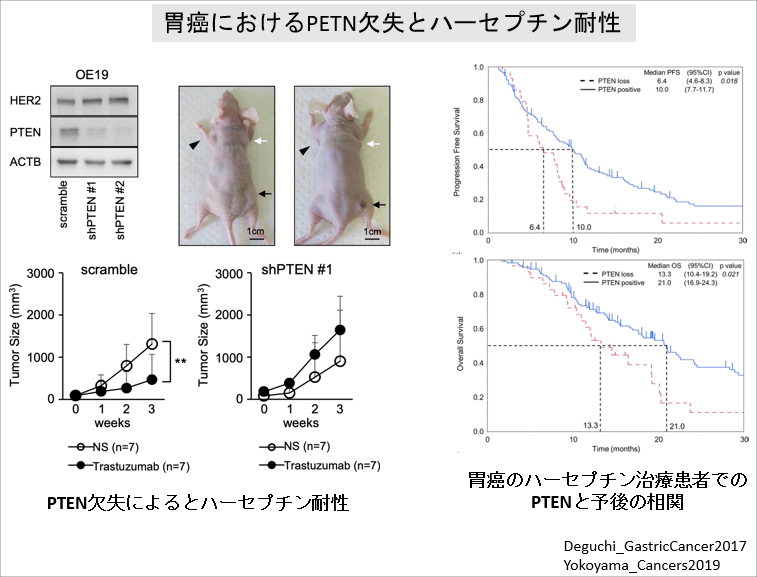
HER2遺伝子と胃癌
HER2発現の有無は胃癌初のバイオマーカーとして、分子標的治療薬ハーセプチンによる個別化治療が進んでいます。
その一方で薬剤耐性も問題となり、その耐性機序にPTENが関与することを見出しました。
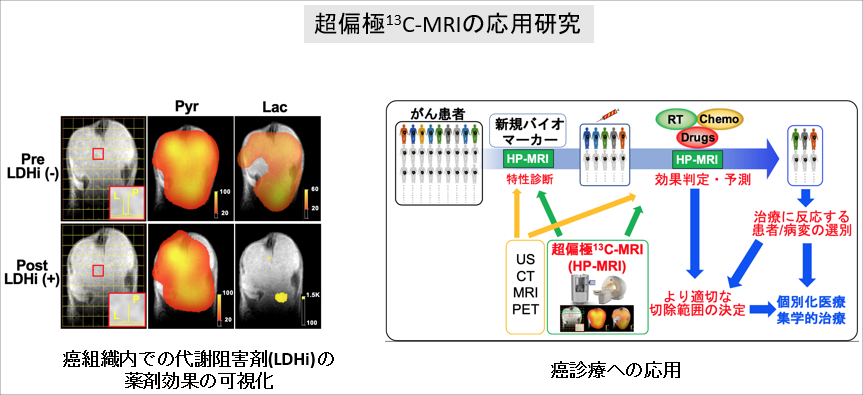
超偏極13C-MRIの応用研究
先進的分子イメージングである超偏極13C-MRIが「個別の組織がもつ生物学的特性を画像化できる」という利点に着目し、この画像技術を癌治療における薬物治療の効果予測や切除範囲の決定などへ応用する研究を行っています。
個々の患者さんに適した“包括的かつ低侵襲な”治療法を開発することで個別化医療の進展に貢献することを目指しています。
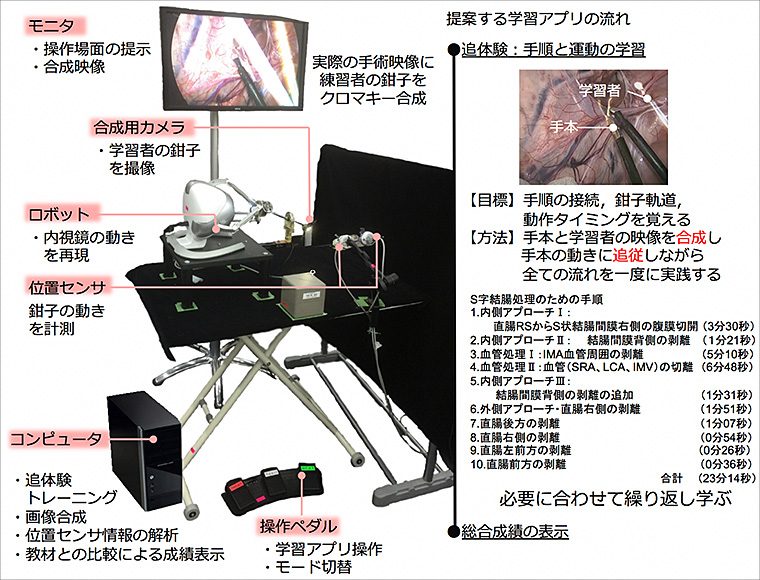
新しい内視鏡外科手術教育システム
限られた空間で動作制限のある鉗子を用いた内視鏡外科手術は、技術の習得に多くの努力を要します。
一方で、できるだけ身体への負担が少ない低侵襲手術を求める患者さんのニーズは大きく、効率的な内視鏡外科手術のトレーニングシステムを開発することは急務といえます。
当科では、大阪大学情報科学研究科の前だ研究室と共同研究を行い、より効率的で楽しく手術トレーニングができる「おいトレ」シリーズを開発しています。
これは「感覚融合技術」を応用した新しい内視鏡外科手術教育システムです。
形態学の追求と解剖所見に基づく手術手技の定型化
内視鏡下手術の導入により、これまでは肉眼的限界または空間的制限により把握困難であった臨床生体解剖が明らかになりつつあります。
自律神経や膜、筋肉組織、画像所見、肉眼所見(手術所見、解剖献体)、組織学的所見などを合わせて検討し、更に予後との関係を調べることにより、根治性と機能温存を両立させる手術がを目指しています。